Importer des produits étrangers en Suisse : quelques normes à respecter

Grâce aux différents accords qui lient la Suisse à de nombreux pays, l’importation de produits étrangers y est largement facilitée. Il existe toutefois quelques normes à respecter lorsque l’on désire importer des produits étrangers vers la Suisse et qui varient en fonction de la catégorie du produit concerné.
Pour des raisons sanitaires et de sécurité, certains produits sont soumis à des exigences particulières avant d’être importés et commercialisés en Suisse (par exemple les médicaments, les cosmétiques ou encore les produits d’entretien). Ces produits doivent également respecter les dispositions relatives à la protection de l’environnement et des consommateurs, et doivent par conséquent être conformes aux normes internationales et nationales.
C’est le législateur qui décide, sur la base du potentiel de nocivité d’un produit, des procédures d’évaluation de la conformité qui doivent être appliquées. Ces dernières peuvent être effectuées par :
- Le fabricant lui-même (par exemple pour les machines)
- L’autorité publique compétente (par exemple pour les médicaments)
- Un tiers indépendant (par exemple les organismes d’évaluation de la conformité)
Ces procédures sont importantes puisqu’elles permettent à la fois de protéger le consommateur et de garantir la qualité des produits importés en Suisse. Toutefois, les lois et les ordonnances qui régissent l’importation de ces produits varient en fonction du pays exportateur et du type de produit importé. Nous vous présentons ci-après quelques cas particuliers mais essentiels à connaître lorsque l’on importe des produits vers la Suisse.
Accords et principes qui facilitent l’importation de produits étrangers vers la Suisse
Il existe des accords entre la Suisse et des pays étrangers qui facilitent le commerce international, et donc l’importation de produits étrangers en Suisse. Les principaux accords sont les Accords de reconnaissance mutuelle (ARM), reconnus dans le cadre de l’Organisation mondiale du commerce (OMC). Ils visent notamment à supprimer les obstacles techniques au commerce dans le domaine régulé par l’État. De ce fait, si les réglementations des produits dans deux États sont comparables, il suffit d’une évaluation de la conformité effectuée dans l’État exportateur selon les règles de celui-ci pour que le produit concerné puisse être mis en circulation dans l’autre État contractant. A l’inverse, si les prescriptions techniques divergent entre les deux pays concernés, le producteur doit fabriquer des séries différentes pour les deux marchés de destination.
L’ARM le plus important pour la Suisse sur le plan de la politique économique est celui conclu avec l’Union européenne (reconnaissable grâce au sigle CE qui désigne la Conformité Européenne). En reprenant largement les règles de l’UE dans le domaine de la sécurité des produits, la Suisse facilite ainsi les exportations et les importations entre elle et l’UE. Toutefois, il existe également des ARM entre la suisse et des pays extérieur à l’UE :
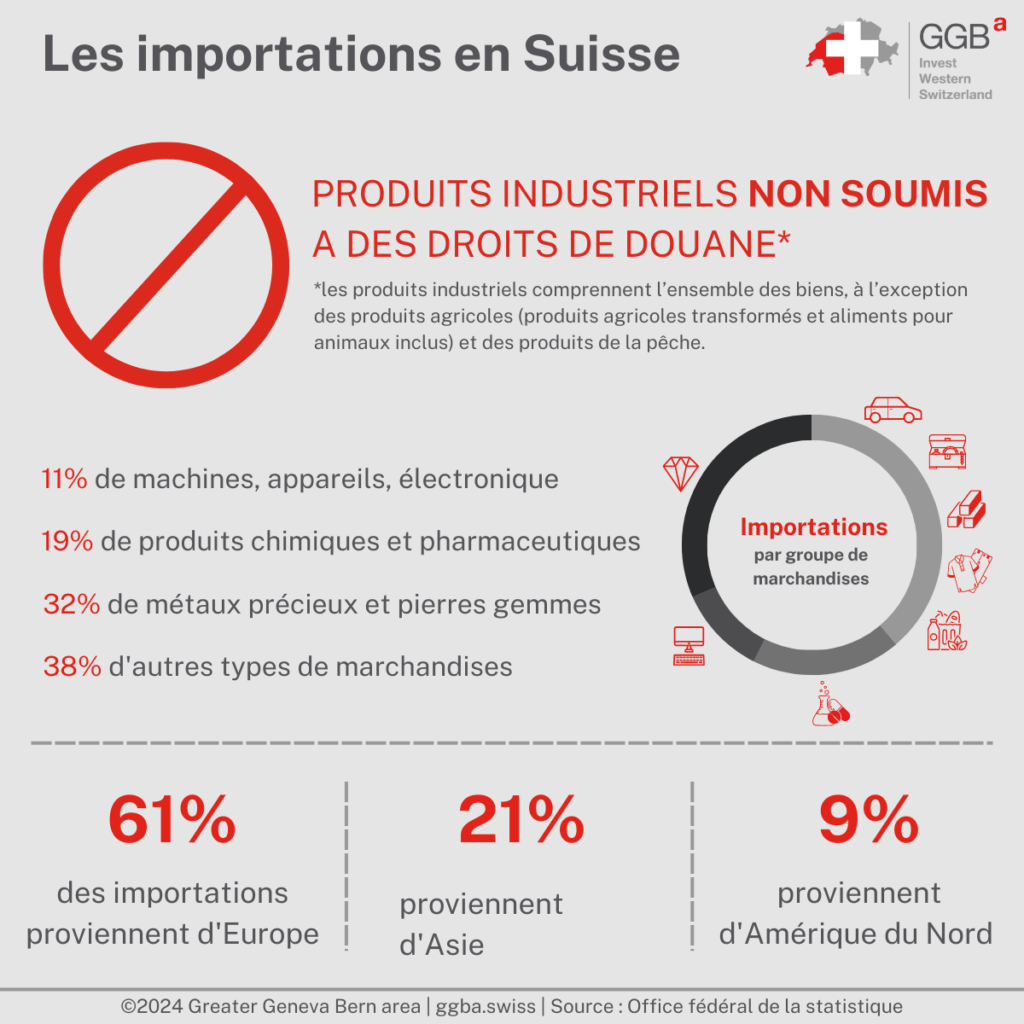
À partir du 1er janvier 2024, la Suisse voit un changement important dans sa politique commerciale avec l’abolition des droits de douane industriels. Cette décision, annoncée par le Conseil fédéral, marque un tournant décisif vers le renforcement de la compétitivité des entreprises suisses et la réduction du coût des importations. La suppression de ces droits de douane devrait profiter à la fois au secteur industriel et aux consommateurs, car elle réduit le coût des produits étrangers, y compris les biens de consommation tels que les voitures, les bicyclettes, les produits de soins personnels, les appareils ménagers et les vêtements. Cette mesure s’inscrit dans le cadre des efforts déployés par la Suisse pour réduire les obstacles au commerce et rationaliser les procédures d’importation, en complément des accords existants tels que les ARM et le principe du Cassis de Dijon. Le Principe du Cassis de Dijon permet aux produits de l’UE et de l’Espace économique européen (EEE) d’être importés en Suisse sans devoir être remballés ou recevoir une nouvelle étiquette pour le marché suisse. Cela est le cas uniquement si les produits correspondent bel et bien aux spécifications du pays de l’UE ou de l’EEE où ils sont légalement commercialisés.
Finalement, il est important de souligner que le droit suisse en matière de responsabilité du fait des produits correspond largement aux règles en vigueur dans l’UE : le producteur répond objectivement des dommages causés par un produit défectueux. Aussi, il est primordial de connaître les lois et les ordonnances qui entourent l’importation de produits étrangers vers la Suisse en fonction de la catégorie du produit importé. Nous présentons ci-dessous les particularités des catégories de produits principalement importées en Suisse : il est néanmoins possible de trouver des informations complémentaires concernant d’autres types de produits sur le site de la Confédération suisse.
Les denrées alimentaires
L’ordonnance suisse sur l’identification et la réclame de denrées alimentaires (ODAIOUs) établit des règles de déclaration strictes à propos des denrées alimentaires :
- Tous les composants doivent être indiqués sur les emballages ou les étiquettes des produits préemballés, par ordre décroissant de quantité.
- Les denrées alimentaires qui ne sont pas décrites dans une ordonnance de la Confédération sont soumises à l’autorisation de l’Office fédéral de la santé publique (OFSP).
- Les denrées alimentaires, les additifs et les auxiliaires technologiques qui sont des organismes génétiquement modifiés (OGM), qui en contiennent ou qui en sont extraits, et qui sont destinés aux consommateurs sont également soumis à l’autorisation de l’OFSP. Il est important de savoir que l’existence d’OGM est tolérée si la part d’un ingrédient ne dépasse pas 0,9%. Au-delà de ce pourcentage, le produit est soumis à autorisation.
- Les allégations nutritionnelles et de santé doivent respecter les dispositions légales conformément à l’ODAIOUs.
- Aucun produit commercialisé en tant que denrée alimentaire ou denrée alimentaire spéciale ne peut faire mention de vertus curatives. Les produits prônant des propriétés curatives sont des médicaments et sont, de ce fait, soumis à une autorisation délivrée par l’Institution suisse des produits thérapeutiques Swissmedic.
A noter qu’il existe un régime particulier décrété par le Parlement suisse dans le cadre du Principe du Cassis de Dijon (cité précédemment) pour les denrées alimentaires. En effet, les denrées de l’étranger qui ne correspondent pas complètement aux spécifications techniques de la Suisse doivent être soumises à l’autorisation de l’OFSP.
Les produits pharmaceutiques
La fabrication et la distribution de médicament sont toujours soumises à autorisation en Suisse. Pour autoriser un nouveau produit pharmaceutique, il faut s’adresser à Swissmedic. L’examen normal d’une demande d’agrément pour un médicament destiné aux êtres humains contenant de nouveaux agents coûte CHF 80’000.-, et CHF 30’000.- pour les médicaments comportant un agent actif reconnu comme novateur. Comme les conditions requises sont largement similaires à celles de l’UE, le dépôt simultané des dossiers en Suisse et dans l’UE est simplifié. En Suisse, l’autorisation prend quelques mois (en dehors du temps consacré au sein de l’entreprise), ce qui en fait l’une des procédures d’enregistrement les plus rapides au monde. Le processus d’autorisation suisse bénéficie également d’une excellente réputation à l’international notamment grâce aux critères stricts de validation mis en place et aux nombreux hôpitaux de premier rang pour les essais cliniques.
Les dispositifs médicaux
Les dispositifs médicaux ne sont pas soumis à une autorisation officielle. Pour ces derniers, la Suisse s’appuie sur les prescriptions liées au système d’évaluation de la conformité et de certification de l’UE. Pour être considérés comme conformes en Suisse, ces dispositifs médicaux doivent porter le marquage CE d’un laboratoire européen approuvé, à condition que l’information relative au produit soit entièrement rédigée en trois langues (allemand, français, italien). De la même manière, un producteur sis en Suisse peut apposer la marque CE sur ses dispositifs médicaux et les vendre sur le marché suisse ou les exporter dans l’UE, l’AELE et la Turquie. À noter que quelques-uns de ces États exigent, en plus du marquage CE, une notification de certains dispositifs médicaux et de leurs producteurs aux autorités nationale. De plus, les États non membres de l’UE exigent parfois des certificats d’exportation du pays d’origine, certificats pouvant être commandés auprès de Swissmedic. De plus, suite à l’annonce du Conseil fédéral paru le 28 novembre 2022, les dispositifs médicaux bénéficiant d’une autorisation de la U.S. Food & Drug Administration (autorisation FDA) sont également reconnus en Suisse.
En deux mots : les importations vers et les exportations depuis la Suisse sont facilitées grâce aux accords qui lient ce pays à de nombreux pays étrangers. Cependant, il est nécessaire de connaître les lois et les ordonnances qui concernent les différentes catégories de produits pour que ces transactions puissent se faire sans encombre.
Le Greater Geneva Bern area (GGBa) est l’agence de promotion économique de Suisse occidentale. Si vous désirez en savoir plus sur les modalités d’importations de produits étrangers vers la Suisse ou sur d’autres sujets susceptibles de vous aider dans votre implantation, contactez-nous.
Nos articles « Why Switzerland » peuvent répondre aux questions que vous vous posez.